MATERIAL
1) Tubo de ensayo
2) Glucosa
3) Agua destilada
4) Fehling A
5) Fehling B
6) Papel indicador
7) Ácido clorhídrico (HCL)
8) Lactosa
9) Sacarosa
10) Hidróxido de Sodio (NaOH)
11) Sacarasa
12) Probeta de 10ml
13) Baño maría
14) Pinzas de madera
15) Varilla de vidrio
1. Investigación del poder reductor de los monosacáridos
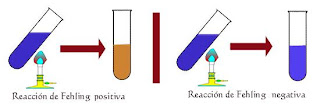
a) Disolvemos un poco de glucosa en 3 ml de agua destilada en un tubo de ensayo, añadimos 5 gotas de fehling A y otras 5 gotas de fehling B comprobamos con el papel indicador que el medio es básico, calentamos el tubo de ensayo al baño maría, lo sacamos del baño maría y observamos un oxido cuproso de color rojo ladrillo, eso es debido a que la glucosa actúa con poder reductor sobre el sulfato de cobre (II) de color azul, dejándolo a oxido de cobre (I) de color rojo-anaranjado
b) Disolvemos una pequeña cantidad de glucosa en 3ml de agua destilada en un tubo de ensayo. Añadimos 5 gotas de fehling A y otras 5 gotas de fehling B y además unas gotas de ácido clorhídrico hasta que el medio se vuelva ácido (comprobamos con el papel indicador). Calentamos el tubo de ensayo al baño maría, y comprobamos que se produce una reacción de Fehling negativa, en un medio ácido, y quedando del mismo color azul
2. Investigación del poder reductor en los disacáridos.
a) Disolvemos un poco de lactosa en 3ml de agua destilada en un tubo de ensayo. Añadimos 5 gotas de Fehling A y otras 5 gotas de Fehling B. comprobamos con papel indicador que el medio es básico. Calentamos el tubo de ensayo al baño maría, y observamos que se realiza la reacción de Fehling positiva, dejando un oxido cuproso de color rojo-anaranjado, esto se debe a que la lactosa contiene un carbono aldehído libre.
b) Disolvemos un poco de sacarosa en 3ml de agua destilada en un tubo de ensayo. Añadimos 5 gotas de Fehling A y otras 5 gotas de Fehling B. comprobamos con papel indicador que el medio es básico. Calentamos el tubo de ensayo al baño maría, y observamos una reacción de Fehling negativa, esto se debe a que los carbonos reductores de la sacarosa (constituido por glucosa y fructosa), reaccionan entre sí para formar el disacárido, perdiendo su poder reductor.
3. Hidrólisis de la sacarosa con HCL (ácido clorhídrico)
Disolvemos un poco de sacarosa en 3ml de agua destilada en un tubo de ensayo. Añadimos 1ml de HCL para romper los enlaces de la glucosa y fructosa y utilizamos el licor de Fehling como se indica en el apartado 1.a, pero antes neutralizamos la disolución con NaOH (recuerda que la reducción solamente ocurre en medio básico) y comprobar el pH con el papel indicador, y observamos un reacción positiva de color rojo-anaranjado, esto se debe a que el HCL rompe los enlaces de la glucosa y la fructosa, recuperando su poder reductor.
4. Hidrólisis enzimática de la sacarosa
Disolvemos un poco de sacarosa en el 3ml de agua destilada en un tubo de ensayo, añadimos unas gotas de sacarasa para romper los enlaces de la glucosa y la fructosa y calentamos el tubo con la mano durante dos o tres minutos. Comprobamos que se ha realizado la hidrólisis utilizando licor de Fehling como indica el apartado 1.a. aquí no es necesario neutralizar la disolución. En todo caso comprobamos antes que el medio sea básico; si no lo fuera, vertimos unas gotas de NaOH en el tubo de ensayo, y observamos una reacción positiva de color naranja, esto se debe a que la sacarasa a separado los enlaces entre la glucosa y la fructosa, habilitando el poder reductor de la sacarosa.
EL COLORÍMETRO Y SU MANEJO
INTRODUCCION
EL COLORÍMETRO Y SU MANEJO
ANÁLISIS COLORIMETRICO DE UNA DISOLUCION DE CuSO4
DE CONCENTRACIÓN DESCONOCIDA
El colorímetro es un aparato que sirve para la determinación cuantitativa de disoluciones coloreadas.
Es decir, permite averiguar la concentración de cualquier disolución siempre que sea coloreada.
El colorímetro se utiliza en los laboratorios de investigación, en las industrias alimentaria, en los hospitales, en conservación medioambiental etc.
FUNDAMENTO TEORICO
El colorímetro consta de una lámpara halógena de tungsteno que emite un haz que es concentrado por una lente. La luz emitida se compone de todos los colores del espectro lumínico (desde el rojo hasta el violeta) y es proyectada sobre una muestra de disolución que se pretende estudiar. Un filtro coloreado selecciona el color de luz mas adecuado para el estudio de la muestra de que se trate. El color del filtro ha de ser complementario al que se presenta en la muestra. Por ejemplo, si la disolución es de color verde el filtro será amarillo; si es azul el filtro será rojo, etc. El color complementario es le que mas absorbe la disolución y precisamente lo que se busca es utilizar el color que sea retenido al máximo por la muestra.
La disolución absorberá la mayor parte de ese color pero no todo; la luz que atraviesa el filtro es recogida por una fotocélula, que es detector fotovoltaico de silicio que convierte la energía luminosa en una corriente eléctrica. Finalmente una pantalla digital nos muestra la intensidad de energía eléctrica recibida. Esta cantidad de energía se denomina transmitancia (porque es proporcional a la luz trasmitida) y se mide en %. Un 100% quiere decir que toda la luz emitida ha atravesado la disolución. La cantidad de luz absorbida determina la absorbancia, que es un dato complementario a la transmitancia. Por ejemplo, si la transmitancia es el 20%, la absorbancia es el 80%. Generalmente se prefiere trabajar con valores de absorbancia.
MATERIALES
-
Tubo de ensayo
-
Disoluciones de CuSO4
-
El colorímetro
-
Papel milimetrado
Tubo de ensayos
Disoluciones de CuSO4
Papel milimetrado
Colorímetro
PROCEDIMIENTO
-
Pulsa el interruptor para encender la lámpara halógena.
-
Seleccionar la posición de transmitancia “t%”. La pantalla digital mostrará el número 1, lo que indica que la totalidad de la luz emitida llega a la célula fotovoltaica.
-
introducir un filtro en el compartimiento adecuado. El filtro para esta práctica será el naranja (620nm) o el rojo (660nm).
-
colocar un tubo de ensayo con agua destilada en el compartimiento de muestra, de forma que la flecha grabada en el tubo apunte hacia la ranura blanca de dicho compartimiento.
-
Ajustar la transmitancia al 100%la absorbancia es el 0%. Cambiar a la absorbancia (ABS) con el interruptor T%-ABS.
-
Una vez que la transmitancia al 100%utilizando el mando “COARSE” de ajuste rápido y el “FINE” de precisión.
-
Introducir sucesivamente cinco muestras de las disoluciones de CuSO4 conocidas, empezando por la más diluidas, y anotar en una pequeña tabla de datos los valores de absorbancia registrados.
Modelo de tabla:
|
CONCENTRACIÓN Y ABSORBANCIA DE CuSO4 |
|||||
|
Molaridad |
0,2 |
0,4 |
0,6 |
0,8 |
1,0 |
|
Absorbancia |
0,44 |
0,77 |
1,16 |
1,57 |
1,99 |
-
Con los datos de absorbancia obtenidos hay que tener una grafica de coordenadas cartesianas, en la que la absorbancia en ordenadas y en abscisas la concentración de CuSO4 de 0M a 1M (utiliza papel milimetrado). Trazar una línea recta que pase por los puntos lo mejor posible. Hay que poner un titulo a la gráfica.
Abs%²
2 ●
1,6 ●
1,2 ●
0,8 ●
0,4 ●
0,2 0,4 X 0,6 0,8 1,0 M
-
Medir la absorbancia de la muestra de la disolución desconocida. La grafica anterior te permitirá conocer la concentración correspondiente.
|
CONCENTRACIÓN Y ABSORBANCIA DE CuSO4 |
X |
|||||
|
Molaridad |
0,2 |
0,4 |
0,6 |
0,8 |
1,0 |
0,42 |
|
Absorbancia |
0,44 |
0,77 |
1,16 |
1,57 |
1,99 |
0.94 |
CONCLUSIÓN
-
Diferentes sustancias químicas absorben diferentes frecuencias de luz.
-
Un colorímetro es un instrumento que permite la absorción de una solución en una específica frecuencia de luz a ser determinada
-
La cantidad de absorbancia varia cuando mayor o menor sea su molaridad
-
Mientras mayor sea la molaridad, el CuSO4 tendrán un azul más oscuro